2013년, cryo-EM의 resolution revolution 이후로 인해 결정화된 샘플을 필요로 하지 않으며 미량의 샘플로도 구조를 규명할 수 있는 cryo-EM을 결정 생성이 어렵고 상대적으로 대량 발현이 어려운 세포막 단백질 구조 연구에 응용하기 위한 시도가 꾸준히 진행되고 있다. 실제로 2013년 이후 Cryo-EM을 이용하여 규명된 단백질 입체 구조 수가 급격하게 증가하고 있으며, cryo-EM은 향후 X-ray Crystallography와 더불어 구조생물학의 핵심 기술이 되어가고 있다.
Cryo-EM을 이용한 단백질 구조 분석은 균일한 단백질 샘플을 일정한 간격으로 구획화되어있는 그리드 위 필름에 퍼트리는 것으로 시작된다. 이 그리드를 cryo-TEM을 이용하여 타겟 단백질의 random oriented 2D projection 이미지를 얻을 수 있으며, 이를 기반으로 컴퓨터적 연산을 통해 3D 구조를 재구축 할 수 있다.
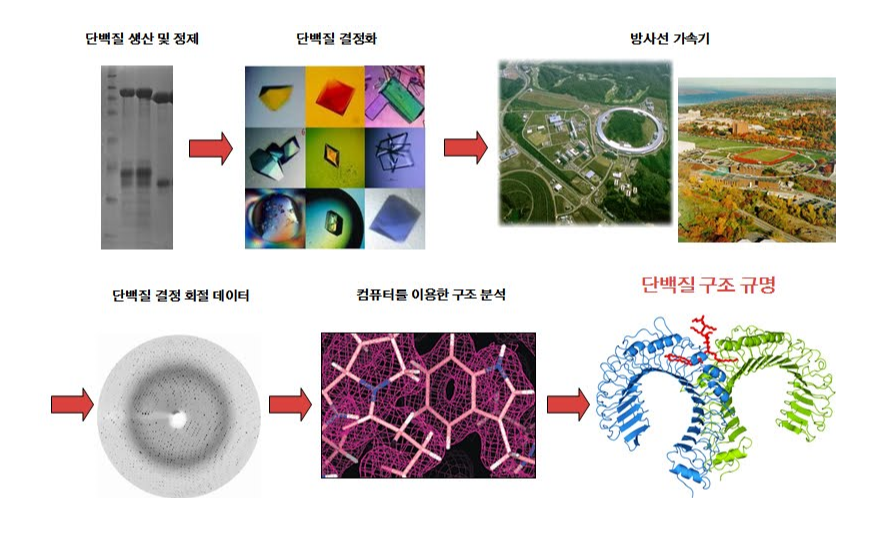
19세기 말, 뢴트겐(Wilhelm Conrad Röntgen, 1901년 노벨 물리학상)이 우연히 발견한 X-선은 현대 물리학과 의학 발전에 지대한 영향을 끼쳤고 단백질이나 DNA와 같은 생체 분자가 어떻게 생겼는지 고해상도로 관찰하는 것을 가능하게 한 초석이 되었다. X-선을 이용해서 단백질의 생김새를 보는 것은 현미경의 원리와 비슷하다.
다만 가시광선을 광원으로 사용하는 일반 광학현미경으로는 0.5 마이크로미터 이하의 작은 물질은 볼 수가 없기 때문에, 단백질의 구조를 보기 위해서는 파장이 짧은 X-선을 광원으로 이용해야 한다. 문제는 X-선이 워낙 투과력이 좋아 단백질 시료에 의해 회절되는 상을 현미경 렌즈로 모을 수가 없다는 데 있다.
이를 해결하기 위해서 단백질의 회절 신호를 직접 디텍터(detector)로 모으고 난 후, 이를 푸리에 변환하면 α-helix, β-sheet, loop로 이루어진 단백질의 상을 볼 수 있는 것이다. 하지만 단백질 하나가 만드는 회절 데이터는 그 신호가 너무 약하기 때문에, 회절 신호를 증폭하기 위해서 단백질을 순수 전제한 후 3차원으로 질서 정연하게 배열된 결정(crystal)을 만든다. X-선은 입자이면서 파동이기 때문에 단백질들이 만드는 각각의 회절 파동이 정확하게 중첩되면 비로소 구조 분석을 할 수 있는 강한 신호를 얻을 수 있다.