Research
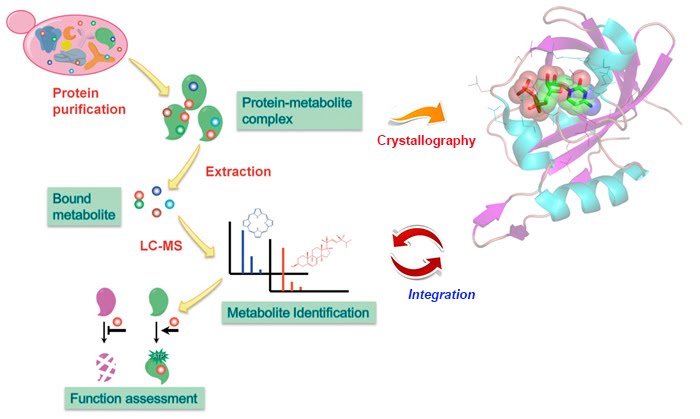
It is estimated that at least 50% of the protein sequences in the database are unannotated, or misannotated, imparting a great challenge to biochemists in post-genomic era. To overcome this problem, future direction of enzymology must focus on discovery of the in vivo function of the unknown gene products. Our lab utilizes biochemical and structural tools (X-ray crystallography) to investigate protein-ligand interactions, which will provide immediate insights into the protein function and a potential regulatory mechanism in cells. We are particularly interested in enzymes that are essential for the survival of bacterial cells. Therefore, discovery of a tight binding ligand with such target proteins not only reveal the novel biological function, but also may provide a critical hint for the developement of antibiotic warheads.
현재 데이터베이스에 올라와 있는 단백질들 중 최소 절반 이상이 생물적 기능이 표기되어있지 않다거나 심지어 잘못 표기 되었다고 추정되는데, 이것은 게놈 프로젝트 이후 세대의 생화학자들이 직면한 큰 과제라고 할 수 있다. 이러한 문제를 해결하기 위해서 효소학 분야는 앞으로 기능이 아직 규명되지 않은 단백질들의 세포내 기능을 알아내는 것에 집중해야 할 것이다. 본 실험실에서는 생화학적/구조학적인 (X-선 결정학) 접근으로 통해 단백질-리간드의 상호작용을 연구하여 세포내에서 단백질의 기능이나 조절 기작에 대한 직접적인 증거를 확보할 계획이다. 그 중 특히 세균들이 생존하는데 절대적으로 필요한, 기능이 알려져있지 않은 단백질들과 강한 결합을 갖는 리간드를 찾아내는 것은 새로운 생물적 기능을 밝히게 될 뿐만 아니라 향후 항생제 개발에 있어서 중요한 기초적인 지식을 제공하게 될 것이다.
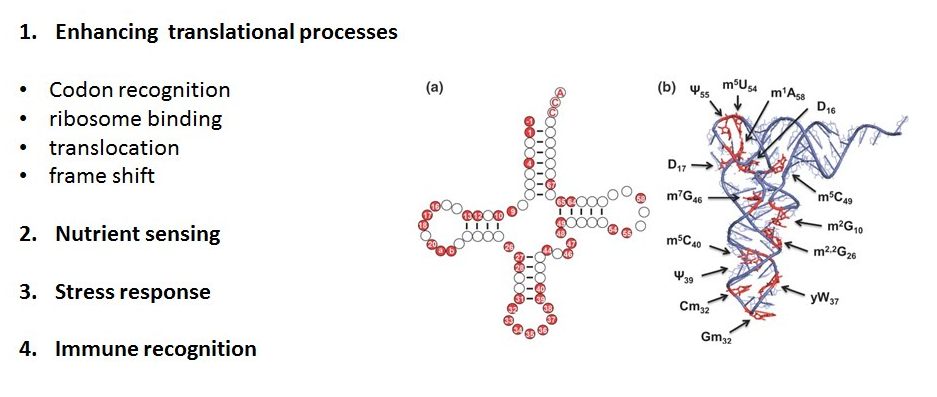
There are over 140 RNA modifications reported to date, most of which occur within tRNA. The enzyme-mediated post-transcriptional modification of nucleotides contributes to a proper folding and stability of tRNA, and especially those located within anticodon loop of tRNA enhance translational processes. Notably, emerging regulatory functions of tRNA modifications have been identified in nutrient sensing, and stress response. However, detailed understanding of how RNA modifications are modulated in response to environmental stress is generally lacking. To address this, we investigate structural and biochemical properties of RNA modifying enzymes in bacteria, yeast and human for probing the molecular mechanism and structural basis of the regulatory function of posttranscriptional modifications.
지금까지 약 140여개의 RNA변형이 알려져 있는데 그중 대부분은 tRNA에 집중되어 있다. 이런 핵산의 전사후 변형은 효소에 의해 일어나는데 tRNA의 적절한 folding이나 안정성에 기여를 하고, 그중 anticodon loop에 위치하는 것들은 리보솜에서 일어나는 번역에 관련된 여러 과정들의 기능을 향상시킨다. 특히 tRNA변형의 세포내 대사 조절 기능이 영양분, 스트레스 요인을 인지하는 등의 예에서 최근 알려지기 시작했는데, 이러한 tRNA 변형이 어떻게 주변환경인자에 반응하여 제어되는지에 대한 자세한 이해가 아직 부족하다. 이런 물음에 대한 답을 얻고자 본 연구실에서는 세균, 효모, 인간등에서 RNA변형을 일으키는 효소의 구조적, 생화학적 성질을 연구하여 그 원자수준의 기작과 전사후 변형의 조절이 어떠한 구조적 이유로 일어날 수 있는지를 밝혀낼 것이다.
 Functional Diverity of tRNA Modification
Functional Diverity of tRNA Modification
More than 100,000 crystal structures are deposited in the Protein Data Bank. However, only about 500 of these structures are integral membrane proteins, despite the fact that they account for about a third of all proteins encoded in the human genome . This lack of high resolution structural information at the atomic level has substantially inhibited the development of new therapeutics due to a lack of basic functional and mechanistic understanding of this important protein class. Two major bottlenecks have thus far impeded the structural characterization of integral membrane proteins: First, the generation of sufficient amounts of material is limited by poor recombinant protein expression. Second, protein crystals tend to be of low quality, small and poorly ordered, yielding only low resolution X-ray diffraction data. We are particularly interested in bacterial membrane proteins which are necessary for viability. Successful structural and functional characterization of this class of proteins will provide critical insights into the developement of novel antibiotics.
단백질을 코딩하는 인간 유전자 개수의 약 30%가 막단백질에 해당하지만 상대적으로 그 구조에 대한 연구는 다른 수용성 단백질들에 비해 상당히 지체되어있다. 그 이유로는 일차적으로 막단백질을 고순도, 고효율로 정제하기가 어렵다는 것이고, 둘째로는 유전자 재조합방식으로 만들어진 막단백질들로부터 고해상도의 X-선 회절 데이터를 얻을 수 있는 결정을 생성하는 단계가 역시 쉽지 않기 때문이다. 우리는 특히 세균의 생명 영속에 필요한 세포막 단백질의 구조생물학 연구에 관심이 있으며 이 클래스의 구조와 기능에 대한 규명은 추후 새로운 항생제 개발에 중요한 정보를 줄 수 있을 것이라고 기대된다.